-
文章 · 2026年02月08日
选择 Opentrons Flex 的 7 大理由
阅读全文 -
文章 · 2026年02月08日
Opentrons Flex 实用操作技巧:新手必读
阅读全文 -
文章 · 2026年02月07日
高通量 NGS 建库流程中的关键步骤与 Opentrons Flex 支持
阅读全文


现代数据分析方法(例如优化算法或深度学习)已成功应用于许多生物技术和医学问题。为了使这些方法有效,需要进行大量高质量且可重复的实验,这需要高度自动化。在这里,我们介绍了一种开源硬件和低成本框架,可以自动高通量生成大量细胞生物学数据。我们的设计包括一个落射荧光显微镜,该显微镜带有自动 XY 载物台,用于移动装有细胞的多孔板,以及一个灌注歧管,允许编程应用多达八种不同的溶液。我们的系统非常灵活,可以轻松适应个人实验需求。为了证明该系统的实用性,我们已使用它进行高通量 Ca 2+成像和大规模荧光标记实验。
介绍
过去十年发展起来的深度学习和人工神经网络 (ANN) 已被证明可用于图像分析、优化任务和机器人技术(LeCun 等人,2015 年;Hinton,2018 年;Hinton 等人,2019 年)。它们在解决生物问题方面也越来越受欢迎。例如,基于 ANN 的细胞分割算法比传统方法更准确、更快(Hilsenbeck 等人,2017 年)。深度学习还有助于检测人体组织中的转化细胞(Van Valen 等人,2016 年;Coudray 等人,2018 年)、优化治疗条件(Kusumoto 和 Yuasa,2019 年)以及解释动物行为(Heras 等人,2019 年)。最近,已经开发了一个在线平台,让没有任何深度学习知识的研究人员可以在自己的应用程序中使用它(von Chamier 等人,2020 年),进一步提高了深度学习作为分析工具的实用性。
应用深度学习和其他机器学习方法时,一个重要的考虑因素是训练数据集的大小。通常,深度学习需要数千到数万个数据点(O'Mahony 等人,2019 年)。这在生物实验中通常是不可行的,因为它们通常需要很长时间才能完成。因此,需要能够在最少的人工监督下执行数百或数千个实验的自动化系统。这种自动化系统应允许 (a) 在多个孔中进行单细胞显微镜检查(明场和/或荧光)(即具有 XY 载物台);(b) 自动应用多种不同的解决方案;(c) 自动在线分析(例如,细胞分割和平均亮度的计算)。
市售荧光显微镜(例如 Olympus BX61、Nikon Ti Widefield 或 Nikon A1 共聚焦系统,以及活细胞成像系统,例如 Echo Revolve 或 Sartorius Incucyte)通常配备 XY 载物台,可进行多孔荧光成像。然而,这些系统价格昂贵(15,000-150,000 英镑),并且仅提供有限的自动化解决方案应用功能。许多市售系统(例如 Hamilton 或 Andrew)都允许这样做,但由于其尺寸和成本,这些系统很难与实时成像相结合。
3D 打印以及 Arduino 和 Raspberry Pie 等廉价电子设备的发展引发了定制经济实惠的科学设备的革命,而这些设备以前只能在大型实验室或大学设施中使用。这些设备不仅经济实惠,而且可以根据各个实验室的需求进行定制。此类技术的一个例子是Baden 等人(2015 年)和Maia Chagas 等人(2017 年)开发的labware.net,它允许 3D 打印极其便宜的实验室设备,从标准可用的微量移液器和微操作器到荧光显微镜和光遗传学解决方案。
最近开发了几种开源高质量显微镜。例如,Diederich 等人 (2020)开发了一个可定制的 3D 打印开源框架,可用于构建各种显微镜:从具有自动对焦功能的简单明场显微镜到具有样品光学切片功能的更复杂的系统。然而,这些资源缺乏用于扫描大量样本的开源系统。Sharkey 等人(2016)针对小动作解决了这个问题,Merces 等人 (2021)针对多孔板的稳健成像解决了这个问题。然而,这些解决方案不提供任何细胞操作,尽管最近已经开发了开源液体处理解决方案(例如,Wijnen 等人,2014 年;Almada 等人,2019 年;Amarante 等人,2019 年;Booeshaghi 等人,2019 年;Samokhin,2020 年;Baas 和 Saggiomo,2021 年)。
在这里,我们介绍了一个开源系统,该系统结合了多孔板中的高通量显微镜、自动化溶液应用、同步荧光成像和图像分析。它成本低(不带荧光显微镜的价格为 400-600 英镑,带荧光显微镜的价格为 2,500 英镑),完全可定制,并且最多可以连续进行 96 或 384 个实验,如果实验不需要高采样率(例如每分钟 1 帧或更高),则可以同时进行。该平台配备一个单通道落射荧光显微镜头,可用于对动态荧光报告基因(例如 GCaMP 和合成钙染料;Razlivanov 等人,2018 年)和/或用荧光抗体或染料标记的样品进行成像。我们展示了我们的系统如何在严格控制和可重复的实验条件下大规模快速生成细胞生物数据。
结果
典型的细胞生物学实验范例通常涉及用生物活性化合物(例如生长因子、钙动员激动剂和细胞毒性剂)处理细胞,并使用荧光报告基因监测细胞行为或固定细胞以便随后进行免疫荧光标记或基因表达分析。为了使此类实验自动化,我们开发了一个实验平台,该平台允许自动对 96 孔板进行成像并使用注射泵应用八种溶液。我们首先介绍该平台并展示其适用性,然后更详细地描述硬件、软件和系统性能。
自动化平台及其适用性
完整组装的系统如图1A所示。硬件由几个主要模块组成:水平移动多孔板的 XY 平台;带有自动对焦系统的小型荧光显微镜(补充视频 1);以及将八种溶液应用到各个孔中的灌注歧管(补充视频 2)。构建说明和所有 3D 打印文件可在https://github.com/frescolabs/FrescoM获得(另见补充文本)。可以使用 Python 编写的用户界面操作硬件(图 1B,有关详细信息,请参阅“软件”部分),该界面控制平台、物镜和歧管以及自动对焦、曝光、照明和实验方案的整体管理。
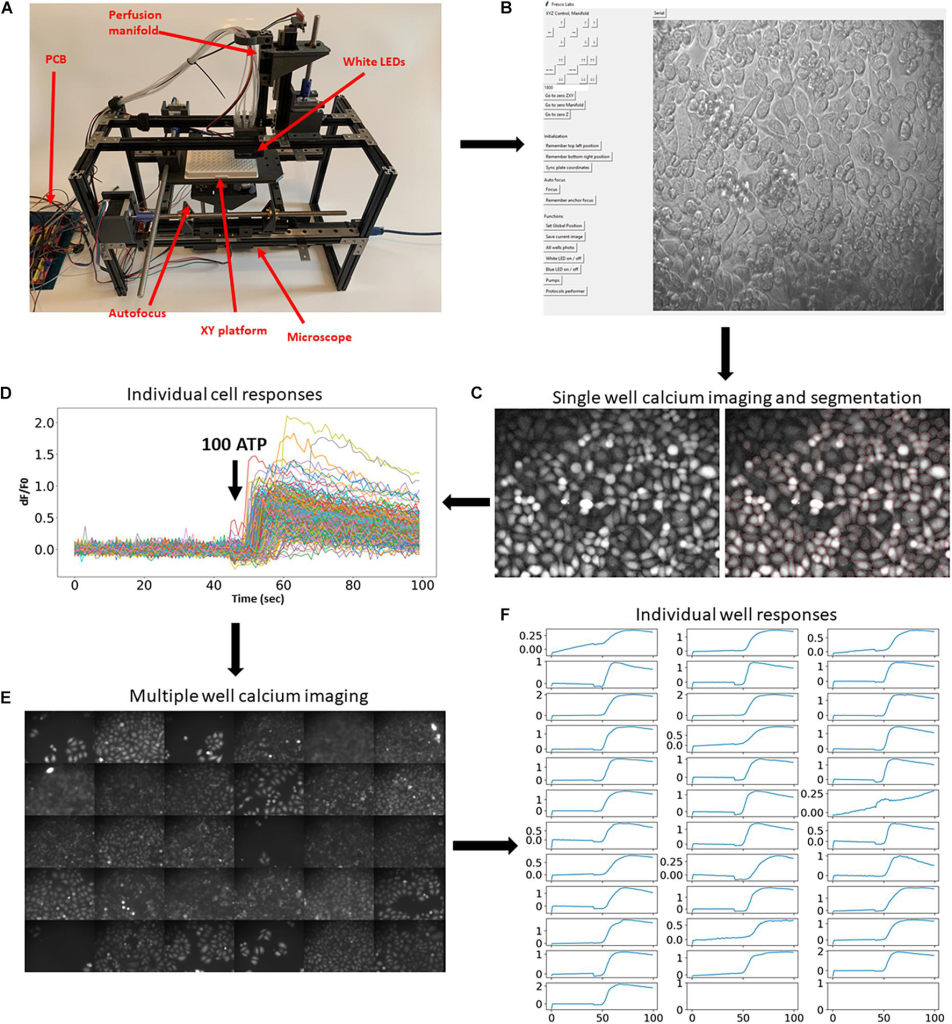
为了展示该平台,我们首先演示了它如何用于大规模荧光成像实验(Nasu et al., 2021)。涉及荧光报告基因的典型实验方案需要在应用激动剂、生长因子或其他活性化合物之前和之后对细胞进行一段时间的成像。为了证明开发的实验平台对这种实验范式的可用性,我们使用合成的钙浓度荧光指示剂进行了钙成像。细胞自动用荧光钙染料 Fluo4-AM 标记(图 1C),并响应 100 μm ATP 进行钙成像。然后使用 Cellpose 算法(Stringer et al., 2021 )自动分割细胞(图 1C ,右) ,并提取单个细胞的荧光动力学(图 1D)。然后在其他 30 个孔中自动重复相同的实验程序和分析(图 1E、F和补充视频 3)。这些实验表明,开发的平台可以实现荧光报告基因的稳健和自动高通量成像。
所开发系统的另一个重要优势是它允许在大量孔中大规模生成图像。 为了证明这种可用性,我们生成了一个 Python 协议类(补充协议 1,有关详细信息,请参阅“软件”部分),使平台在所有 96 个孔上移动,对每个细胞进行聚焦,并捕获明场或荧光图像。 此类实验的示例如图2A、B所示。 重要的是,该系统允许扫描单个孔并对同一个孔生成多张图像(图 2C),这对于寻找稀有细胞(例如,正在进行有丝分裂/凋亡的细胞或转染效率低下的阳性细胞)很有用。

为了证明所开发的实验平台在标记实验中的可用性,我们使用了荧光小麦胚芽凝集素 (WGA),该物质可突出显示细胞膜。用 PBS 自动清洗五排孔(共 48 个孔),然后加入含有 5 mg/ml 荧光 WGA 的溶液。室温下放置 10 分钟后,用 PBS 清洗 WGA,然后放入荧光显微镜下观察。得到的荧光图像如图2D所示。自动标记可产生具有明确质膜的细胞的清晰图像,从而表明可以使用所开发的平台自动执行常规标记程序。
最后,我们还测试了所开发的平台是否可用于以抗 HER2 抗体(Herceptin)为一抗、以 Alexa 488 偶联的二抗进行免疫荧光染色。用 PBS 和 Herceptin 自动灌注含有 SKBR3 细胞(HER2 高表达)或 HeLa 细胞(HER2 低表达)的孔。室温下孵育 40 分钟后,用 PBS 灌注细胞,然后用二抗灌注。室温下再孵育 30 分钟后,用成像溶液灌注孔并进行荧光成像(图 2E和补充图 1)。得到的图像显示,HER2 水平高的 SKBR3 细胞的细胞膜标记清晰,但受体水平低的 HeLa 细胞的细胞膜标记不清晰,从而证明了自动标记程序的稳健性。
这些示例证明了所开发的实验平台在不同类型的细胞生物学实验自动化方面的广泛可用性。下面,我们将详细描述该平台并在一系列测试中展示其性能。
硬件设计
整体结构由 MakerbeamXL 15 毫米 × 15 毫米挤压件构成,通过 L 形和 T 形铝制支架或 3D 打印部件连接。我们发现使用铝挤压框架代替完全 3D 打印部件(两种型号均可在https://github.com/frescolabs/FrescoM上找到)可以使整个系统更稳定并减少振动(未显示数据)。框架由八个侧面挤压件组成(四个垂直 300 毫米和三个水平 200 毫米,两个在顶部,一个在底部,图 3A)。侧面与两个 400 毫米挤压件相连,用于固定驱动x轴的 MGH12 导轨。y轴(图 3B)位于由四个 200 毫米挤压件构成的方形框架上,并通过两个 3D 打印支架连接到x轴。两个 MGH12 导轨位于框架上,可容纳一个 Nema 17 电机和一个 96 孔板支架(图 3B,y_plate_holder.stl 文件)。
经验丰富的服务团队和强大的生产支持团队为客户提供无忧的订单服务。

简体中文

繁體中文

English

日本語

한국인