-
文章 · 2026年02月08日
选择 Opentrons Flex 的 7 大理由
阅读全文 -
文章 · 2026年02月08日
Opentrons Flex 实用操作技巧:新手必读
阅读全文 -
文章 · 2026年02月07日
高通量 NGS 建库流程中的关键步骤与 Opentrons Flex 支持
阅读全文


已经评估了两种用于从鼻咽拭子中高通量提取 RNA 以检测 SARS-CoV-2 的自动化内部协议。
在 10 天内收集了 141 个 SARS-CoV-2 阳性样本。内部协议基于磁珠提取,设计用于 Opentrons OT-2(OT-2内部)液体处理机器人或 MagMAX TM Express-96 系统(MM内部)。两种协议均与使用 MagMAX TM系统(MM试剂盒)的商业试剂盒并行测试。核酸提取效率是根据 SARS-CoV-2 DNA 阳性对照计算的。
在检测阳性样本方面,内部方案和商用试剂盒之间没有发现显著差异。MM 试剂盒效率最高,尽管内部 MM 试剂盒的平均 Ct 值低于其他两种试剂盒。与商用试剂盒相比,内部方案每提取 96 个样本可节省 350 欧元至 400 欧元。
所述协议利用易于获得的试剂和开源液体处理系统,适用于高通量设施中的 SARS-CoV-2 检测。
引用: Lázaro-Perona F、Rodriguez-Antolín C、Alguacil-Guillén M、Gutiérrez-Arroyo A、Mingorance J、García-Rodriguez J 等人。 (2021)评估两种用于 SARS-CoV-2 检测的自动化低成本 RNA 提取方案。 PLoS ONE 16(2): e0246302。 https://doi.org/10.1371/journal.pone.0246302
编辑: AM Abd El-Aty,埃及开罗大学
收稿日期: 2020 年 11 月 5 日;接受日期: 2021 年 1 月 15 日;发表日期: 2021 年 2 月 16 日
版权所有: © 2021 Lázaro-Perona 等人。这是一篇开放获取的文章,根据知识共享署名许可条款分发,允许在任何媒体中不受限制地使用、分发和复制,前提是注明原作者和出处。
数据可用性:所有相关数据均在论文及其支持信息文件中。
资金:作者未收到此项工作的特定资金资助。
竞争利益:作者已声明不存在竞争利益。
SARS-CoV-2 疫情要求大规模使用 qPCR 检测,以发现阳性病例并追踪接触者,从而阻止社区传播。在 qPCR 检测之前,通常需要对临床样本进行 RNA 提取 [ 1-4 ]。考虑到每天检测的样本数量,大多数机构无法采用手动 RNA 提取方法,因此,自动化系统被广泛用于此任务 [ 5-7 ] 。自动化系统的缺点是,它显著增加了最终成本,这可能会阻碍某些地区的大规模检测。此外,由于需求增加,提取试剂的库存短缺导致诊断严重延迟。
本文介绍了两种低成本的自动 RNA 提取方法。第一种方法使用 OT-2 系统(Opentrons,纽约州纽约市,美国),这是一种能够自动执行自行设计方案的开源液体处理机器人;第二种方法使用快速且易于使用的核酸提取仪 MagMAX TM Express-96 系统(Thermo Fisher Scientific,马萨诸塞州沃尔瑟姆,美国)。后者可在 30 分钟内提取多达 96 个样本,但需要事先手动分配试剂、磁珠和 96 孔板中的样本,这会增加 30 分钟。作为替代方案,OT-2内部方案可以完全自动化地在 104 分钟内处理多达 48 个样本。
在十天内,收集了 141 份连续的 SARS-CoV-2 阳性鼻咽拭子,这些拭子带有病毒运输培养基(西班牙巴塞罗那 Deltalab),并储存在 4°C 下。处理前,将 500 μL 病毒培养基和 500 μL 4M 异硫氰酸胍 (GTC)(德国希尔登 Qiagen)与 5 μg/mL 载体 RNA 混合,使样品失活,然后将样品在 80°C 下加热 2 分钟,并短暂涡旋混合。
核酸自动提取采用两种系统:MagMAX TM Express-96 深孔磁粉处理器(King Fisher Instrument,Thermo Fisher Scientific,美国马萨诸塞州沃尔瑟姆)和开放式系统 OT-2(Opentrons,美国纽约州纽约),配有 GEN1 磁模块(Opentrons,美国纽约州纽约)和内部协议。两种系统均使用 MagMAX™ Express 96 板和深孔板(Thermo Fisher Scientific,美国马萨诸塞州沃尔瑟姆)。
核酸提取采用三种方法:1)根据制造商的说明,使用 MagMAX TM和商用 MagMAX CORE 核酸纯化试剂盒 (MM试剂盒)(Thermo Fisher Scientific,美国马萨诸塞州沃尔瑟姆);2)OT-2 系统采用通用试剂(OT-2内部),例如乙醇(Emsure®,Merck KGaA,德国达姆施塔特)、2-丙醇(Emsure®,Merck KGaA,德国达姆施塔特)、洗脱缓冲液(Omega BIO-TEK,美国佐治亚州诺克罗斯)、无核酸酶水(Ambion TM,Thermo Fisher Scientific,美国马萨诸塞州沃尔瑟姆)和磁珠(Mag-Bind® TotalPure NGS,Omega Bio-Tek,美国佐治亚州诺克罗斯);3)MagMAX TM采用与商用试剂盒相同的协议,但使用 OT-2 方法中的试剂(MM内部)。内部协议是 Hui He 等人描述的程序的修改版[8]。简而言之,将灭活的呼吸道样本以 1:1 的比例与异丙醇混合,至最终体积为 500 μl(内部OT-2)和 1000 μL(内部MM),加入 40 μL 磁珠并在室温下孵育 5 分钟。接下来,用磁铁将磁珠拉到管的一侧并弃去上清液。然后用 500 μL 新鲜制备的 70% 乙醇洗涤磁珠两次。第二次洗涤后,弃去 70% 乙醇并在室温下风干磁珠。最后,将珠子重新悬浮在 100 μL 洗脱缓冲液中并再次用磁铁分离以回收洗脱的病毒 RNA(表1)。
表 1.所评估的三个方案中使用的步骤、试剂和体积(μL)。
MM内部协议:
OT-2内部协议:
OT-2内部协议是根据 Opentrons 说明用 Python 编写的。脚本已存放在 GitHub 存储库中
为了验证内部核酸提取方案的性能,使用 DNA 阳性对照 TaqMan 2019-nCoV 对照试剂盒 v1(赛默飞世尔科技,美国马萨诸塞州沃尔瑟姆)制作了标准、低和极低病毒载量的模拟样本。对照试剂盒的浓度为 1 x 10 4拷贝/μL。标准病毒载量样本的制备方法是将 10 μL 阳性对照与 490 μL 病毒运输培养基和 500 μL GTC 混合。低和极低病毒载量的制备方式相同,但使用阳性对照的十倍连续稀释液。所有模拟样本均制备三份,并与内部OT-2 、MM试剂盒和内部MM并行处理,然后使用 TaqMan 2019-nCoV 检测试剂盒 v1 进行 qPCR 测试。标准、低和极低病毒载量的模拟样本中阳性对照的最终浓度分别为 1 x 10 6拷贝/mL、1 x 10 5拷贝/mL 和 1 x 10 4拷贝/mL。所有运行均包括阴性对照。
通过将模拟样本中阳性对照的 Ct 值 (Ct ss ) 与直接从库存制备的阳性对照的 Ct 值进行比较来计算核酸提取效率,校正量以匹配稀释因子和每个方案中使用的初始样本量 (Ct pc ) (R = 2 -ΔCt = 2 -(Ctss-Ctpc) )。
使用针对orf1ab、刺突 (S)、核衣壳 (N) 和人 RNaseP 基因的 TaqMan 2019-nCoV 检测试剂盒 v1 以及作为阳性对照的 TaqMan 2019-nCoV 对照试剂盒 v1,按照制造商推荐的 qPCR 条件对 SARS-CoV-2 病毒 RNA 进行核酸扩增。所有 qPCR 检测均在 CFX96 Touch 实时 PCR 检测系统 (Bio-Rad,美国加利福尼亚州赫拉克勒斯) 中进行。为了减少检测间差异,提取的核酸样本使用另一个 OT-2 模块自动分配到 qPCR 试纸中。
成对比较了这三种方案。使用 McNemar 检验来比较它们将样本分配为阳性或阴性的表现。Ct 值不呈正态分布,因此使用 Wilcoxon 符号秩检验来比较每个目标的 Ct 值。对于每个目标,仅考虑通过这三种方法扩增的样本。使用 bootstrap 方法计算中位置信区间。
所有统计测试均采用 IBM SPSS Statistics 24.0.0.0 软件包(SPSS Inc.,美国伊利诺伊州芝加哥)执行。
通过提取用模拟不同病毒载量的 SARS-CoV-2 阳性对照制备的模拟样本,将两种内部方案的核酸提取效率与 MM试剂盒方案进行了比较。MM试剂盒和 OT-2内部方案成功扩增了所有具有标准病毒载量的模拟样本中的orf1ab、S 和 N 靶标。对于这些样本,所有重复和基因的平均提取效率为 MM试剂盒33.9%(SD:13.8),OT-2内部方案19.6%(SD:2.2),MM内部方案16.0%(SD:5.03) 。
在低病毒载量模拟样本中,MM试剂盒无法扩增所有样本中的 S 靶标,也无法扩增其中一个重复样本中的 N 靶标,而 OT-2内部和 MM内部检测出了所有基因。最后,MM试剂盒和 OT-2内部方案无法扩增极低病毒载量样本,除了一个重复样本,其中 N 基因可以通过 OT-2内部方案扩增,但 MM内部可以检测到所有样本中的阳性对照,其中一个样本含有三个靶标,一个样本含有 orf1ab和N 靶标,最后一个样本含有orf1ab靶标(S1 表)。
收集的 141 份阳性临床样本同时使用 MM试剂盒、OT-2内部方法和 MM内部方法进行核酸提取,并通过 qPCR 检测洗脱的 SARS-CoV-2 RNA。记录每个目标的阳性/阴性结果和扩增循环阈值 (Ct)。根据制造商的说明,当三个目标区域中至少一个扩增且 Ct<40 时,样本被视为阳性。所有运行中包括的阴性对照在所有情况下均产生阴性 PCR 结果。
141 个样本中,123 个样本通过至少一种提取方法检测出 SARS-CoV-2 阳性,而 18 个样本通过三种方法检测均为阴性。这可能是由于样本在采集期间降解所致,因为它们已在 4°C 下储存了约 48 小时 [9]。按方法分类,114 个样本使用 MM试剂盒检测呈阳性,111 个样本使用内部OT-2 检测呈阳性,118 个样本使用内部MM 检测呈阳性。成对比较发现它们检测 SARS-CoV-2 的性能没有显著差异(MM试剂盒Vs OT-2内部,P = 0.5465;MM试剂盒Vs MM内部,P = 0.3865;OT-2内部Vs MM内部,P = 0.0961)。18 个样本通过三种方法中的一些方法检测呈阴性。这些具有较高的 Ct 值, orf1ab和 N 靶标的中值分别为 38.68 和 38.19(在这些样本中,S 靶标未通过任何方法扩增)。比较所有方法和靶标的成对线性回归和相关性分析显示 R 2值在 0.85 和 0.95 之间,Bland-Altman 分析表明在整个 Ct 范围内一致性是一致的(S1 图)。
在使用 MM试剂盒提取的样本中,43% 可检测到三个靶标(orf1ab 、 N 和 S ),在使用内部OT-2 提取的样本中,49%可检测到,在使用内部MM 提取的样本中,49% 可检测到(图 1)。在 34%、39% 和 30% 的样本中检测到了orf1ab和 N 靶标,在 19%、10% 和 17% 的样本中仅扩增了 N 靶标。只有极少数样本因单独扩增orf1ab靶标(6)、orf1ab + S(1)或 N + S(5)靶标而被视为阳性,并且没有样本以 S 基因作为唯一的阳性标记。事实上,该检测中的 S 靶标明显缺乏灵敏度,并且与诊断决策无关。使用 OT-2内部协议检测到两个或三个目标的样本占 87%(97 个样本),使用 MM内部协议检测到两个或三个目标的样本占 82%(95 个样本),使用 MM试剂盒检测到两个或三个目标的样本占 79% (90 个样本)。
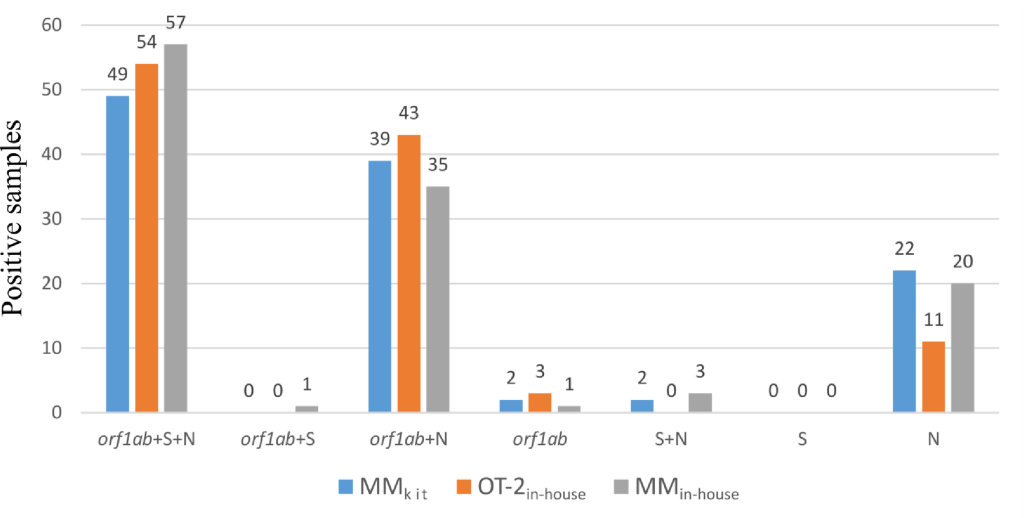
考虑配对样本时,在 orf1ab ( P = 0.437)、N ( P = 0.686) 和 S ( P = 0.794) 靶标的 Ct 值中,MM 试剂盒和 OT-2 内部方案之间的 Cts 没有显著差异( 图 2 )。与 MM 试剂盒 ( orf1ab ; P < 0.00001 , N ; P < 0.00001 , S ; P = 0.00148 )和OT - 2内部方案( orf1ab ; P < 0.00001, N; P = 0.00008, S; P = 0.00252)相比,MM内部方案在所有靶标中的 Cts 确实显著较低。
图 2.箱线图显示使用 MM试剂盒、OT-2内部方法和 MM内部方法获得的orf1ab 、S 和 N 目标的 Ct 值分布。y 轴显示扩增循环 (Ct)。显示每个数据集上的数据点数量。
使用 MM试剂盒、OT-2内部试剂盒和 MM内部试剂盒对orf1ab靶标的中位扩增循环 (CI:95%)分别为 35.53 (33.82–36.36)、35.58 (34.33–36.21) 和 34.8 (33.71–35.29)。对于 S 基因,中位扩增循环 (CI:95%) 为 30.16 (28.56–33.08)、31.32 (29.22–32.88) 和 31.07 (29.36–32.90);对于 N 靶标,中位扩增循环 (CI:95%) 为 34.83 (33.93–35.97)、34.64 (33.42–35.29) 和 34.28 (33.52–35.10)。
使用 OT-2内部协议提取 96 个样本的核酸,总成本为 107 欧元(试剂 37 欧元和实验室器具 70 欧元),实际操作时间为 10 分钟,提取时间为 3 个半小时(脚本每次运行处理 48 个样本,因此必须完成两次)。MM内部成本为 66 欧元(试剂 37 欧元和实验室器具 29 欧元),MM 试剂盒成本为 472 欧元(试剂 443 欧元和实验室器具 29 欧元)。两种协议的实际操作时间均为 40 分钟,提取时间均为 30 分钟。值得注意的是,虽然 96 个样本的 OT-2 协议比 MM内部协议贵 40 欧元,但所需的初始投资明显较低,OT-2 系统(包括模块和移液器)约为 10,000 欧元,MagMAX TM系统约为 50,000 欧元。
本文介绍了两种低成本病毒 RNA 提取和临床样本 SARS-CoV-2 检测方法,其性能与商用试剂盒相当。尽管内部方案提取 DNA 对照的效率低于商用试剂盒,但在临床样本中,整体灵敏度并未受到影响,这可能是因为内部方案使用更大的样本起始量来弥补较低的效率。
设置 OT-2 系统进行 RNA 提取需要对没有经验的团队进行密集编程,但提供了一种经济高效的替代方案,能够在一次运行中提取 48 个样本。这项工作中使用的脚本已上传到开放访问软件存储库 GitHub,在那里可以找到许多用于这些和类似应用程序的协议。这应该有助于其他工作人员避免或减少编程步骤。该协议几乎不需要动手时间,并且使用容易获得的试剂。此外,与其他提取系统相比,该设备所需的投资较低,使其适用于中低资源设施。MagMAX TM Express-96 是一种快速、半自动设备,每次运行能够提取 96 个样本。MM试剂盒提供用于灭活、裂解、洗涤和洗脱的试剂,可以以具有竞争力的成本用于不同的基质和样品类型。另一方面,MM内部协议利用该系统的半开放方法,用其他化学品替代商业解决方案,使其更具成本效益。在这两种情况下,都必须手动准备深孔板、缓冲液和样品,这会增加总提取时间和操作错误风险。这两种内部协议的主要缺点是,当处理粘稠样品时,粘液、高粘性多糖、白细胞、红细胞、血红蛋白、蛋白酶和含有大量细胞核酸的细胞碎屑会阻碍 RNA 提取或抑制 PCR 反应 [ 10-12 ] 。为了部分克服这个问题,可以在提取前对样品进行加热和涡旋或离心,但这会增加动手时间和响应时间。当使用内部MM时,洗脱样品在某些情况下可能含有痕量的磁珠,但这不会影响 RT-PCR 反应的性能。
在这三个系统中,阴性对照在所有情况下均为阴性,表明在这些系统中处理原始样本时不存在交叉污染问题。不过,与非自动化系统一样,应采取预防措施,将 PCR 前和 PCR 后操作分开。如果使用 OT-2 模块设置 PCR 后反应(例如测序),则不应使用它从样本中提取核酸,除非彻底净化。
这项研究的主要优势在于,这些方法都是在临床微生物实验室中用真实样本进行测试的。方法之间的比较并不系统,这是一个重要的限制。事实上,设计的目的是优化每个系统的结果,因此输入是不同的。系统地探索输入样本量以及其他试剂量将是有益和有益的,但这超出了这项研究的目的,即比较临床实验室环境中系统与真实样本的性能。
总之,这里介绍的两种内部核酸提取方法可有效实现 SARS-CoV-2 的高通量诊断,且成本仅为其他商业试剂盒的一小部分,且不损失灵敏度。
经验丰富的服务团队和强大的生产支持团队为客户提供无忧的订单服务。

简体中文

繁體中文

English

日本語

한국인