-
文章 · 2025年07月12日
Opentrons Flex PCR 工作站是否支持荧光定量PCR?
阅读全文 -
文章 · 2025年07月12日
如何用 Opentrons Flex PCR 工作站自动化 PCR 设置?
阅读全文 -
文章 · 2025年07月11日
什么是 Opentrons Flex PCR 工作站?
阅读全文


分子克隆是合成生物学的核心,因为它包括 DNA 的组装及其在靶宿主中的表达。然而,目前克隆通常是一个手动、耗时且重复的过程,自动化将极大地促进这一过程的发展。完整的合理克隆过程(即从 DNA 创建到在靶宿主中表达)的自动化涉及不同操作和机器的集成。此类工作流程的示例很少,尤其是当设计合理(即DNA 序列设计是固定的,而不是基于随机库)且靶宿主在遗传上不太易于处理(例如,对热休克转化不敏感)时。在本研究中,介绍了一种自动化工作流程,用于合理构建质粒并将其随后接合转移到生物技术平台生物谷氨酸棒状杆菌中。整个工作流程都配有定制的软件工具。作为应用示例,构建并表征了基于调节器 Lrp 的合理设计的转录因子生物传感器库。获得了具有改进的动态范围的传感器,并且从筛选中获得的见解为谷氨酸棒杆菌Lrp的双重调节功能提供了证据。
介绍
大宗和精细化学品的微生物生产是实现更可持续的全球经济的重要组成部分。为了促进这一发展,必须提高对微生物生命的基本理解及其工程设计以满足社会需求。近年来,人们提出了采用设计-构建-测试-学习 (DBTL) 循环作为实现这一目标的工具。(1)分子克隆在这一循环中发挥着重要作用,因为它可以生成具有不同特性的新基因型以供探索。
目前已开发出多种软件工具来帮助进行基因型的电子克隆,其数量很容易超过实验室中手动克隆的数量。(2)现在,在短时间内设计数百种基因型已成为可能。例如,一条由 5 个基因组成的生产途径,每个基因具有 3 个不同的核糖体结合位点 (RBS),已经产生了 3 5 = 243 种变体。然而,这种项目的设计相对简单,现在瓶颈转移到实际体外创建这些序列及其在所需工业宿主中的表达。(3)
可以通过使用一锅组装和筛选方法来解决该问题,即获得许多但不一定是全部的变体,并使用筛选试验来选择表现最佳的变体。(4)然而,这些方法有一个缺点:知识仅来自成功构建并从一锅反应中分离的少数变体。更难构建的变体在这种反应中较少,因此不太可能筛选出它们的特性。对于许多基本的生物学问题,这不是一个理想的解决方案。在这里,合理的菌株构建和工作流程所有步骤内所有品种的完整可追溯性是必要的,就像经典分子克隆所实现的那样。
然而,目前分子克隆通常是一个手动、耗时且重复的过程,自动化将为其带来巨大好处。(5)合理克隆工作流程的自动化具有多种好处。实验人员在菌株构建上花费的动手时间可以大大减少。再加上可以实现更高的吞吐量,这大大增加了可以及时生产的构建体的数量。此外,自动化通过消除过程中的随机变化引入了流程的标准化。这些过程也可以更容易地监控和分析,从而更容易找到改进的空间。因此,自动化可以提高克隆工作流程的数量和质量。
近年来,微流体技术已用于实现克隆过程的自动化。(6,7)在这里,定制的微流控芯片用于为单个单元操作提供液体分离和液体转移。虽然这种技术具有将许多单元操作组合在一个设备中的优势,并且能够扩展到每个芯片进行大量实验,但需要高度专业的基础设施和人员来制造芯片并进行实验。
一种更模块化、更方便的解决方案是使用标准液体处理系统,如果需要,还可以使用辅助设备。这样的系统可能相当复杂,能够执行大量具有不同任务的实验,(8−11)而且还有更具成本效益的解决方案可供选择。(12)最近提出的策略利用特定细菌的自然转化能力,从而产生一种高效且易于使用的克隆方法。(13)然而,这种方法仅限于主动吸收外源 DNA 的少数生物。
迄今为止发布的大多数自动克隆工作流程都集中于大肠杆菌。(14)大肠杆菌是一种成熟的分子克隆宿主,在遗传学上非常容易操控。许多遗传工具已被开发和优化用于大肠杆菌,并且有全面的组学数据可用。然而,由于大肠杆菌的低压力耐受性和噬菌体感染风险,它并不总是工业过程的理想宿主。(15)因此,扩展自动化平台以涵盖对其他遗传上较难处理的微生物进行工程改造将是有益的。
谷氨酸棒状杆菌是一种广泛使用的工业细菌(16)由于其对热休克转化等自动化友好型转化过程具有抵抗力,因此其改造难度比大肠杆菌更大。虽然已经朝这个方向采取了一些措施,(17)它们通常无法实现实际目标生物转化过程的自动化,最常见的原因是,电穿孔(针对此类生物的首选方法)不易实现自动化。
本研究提出了一种完整的工作流程,用于自动化合理构建抗热休克微生物菌株。所有工作均使用标准液体处理系统进行。PCR 和 Gibson 组装用于构建 96 个质粒的文库。开发了用于大肠杆菌热休克转化的自动化方案作为穿梭系统。菌落 PCR 和测序用作质量控制。对于转化谷氨酸棒杆菌的最后一步,开发了一种新颖的高通量接合工作流程。接合是一种描述良好且高度相关的细菌转化技术。(18)这种方法效率很高,但由于需要使用琼脂板和滤纸,因此通常比较费力。在本研究中,我们通过使用离心法简化了操作并使其自动化。整个工作流程都配有一个定制的软件工具,用于跟踪所有构建体及其在过程中的状态。
作为应用示例,显示了谷氨酸棒杆菌中不同 Lrp 生物传感器变体的组装和表达。Lrp 生物传感器之前已开发用于检测谷氨酸棒杆菌中的l -蛋氨酸和支链氨基酸。(19)该传感器将细胞内l -蛋氨酸和支链氨基酸浓度与eyfp的表达相结合,后者编码一种荧光报告蛋白。细胞内浓度增加会导致荧光信号增强。一般而言,生物传感器的设计相对模块化;可以通过修改核糖体结合位点和启动子长度等来改变其特性。(20,21)此外,通过设计,它们提供了基因型和表型之间的直接且易于测量的关系;即Lrp 传感器设计的变化可能会导致不同的可测量荧光输出。因此,选择不同 Lrp 生物传感器的合理设计作为应用示例,以展示我们的克隆自动化方法的优势。
结果与讨论
自动化基因工程工作流程
本研究开发的自动克隆工作流程(图1)可分为两个阶段:质粒在大肠杆菌中的组装和扩增以及将质粒转移到目标生物体(本例中为谷氨酸棒杆菌)中。质粒的构建是通过计算机设计部件、通过 PCR 构建片段以及通过 Gibson 组装整合到骨架载体中。之所以选择 Gibson 组装,是因为它允许质粒无疤痕组装。(22)随后通过热休克转化为大肠杆菌。将所得克隆通过冷冻保存,并通过菌落 PCR 进行第一步质量控制。之所以选择这种方法,是因为其成本效益高且运行时间短。该菌落 PCR 的结果影响了接下来的步骤:只有菌落 PCR结果为阳性的大肠杆菌克隆,即得到的 DNA 片段具有预期大小,表明片段成功组装到主链中,才会被考虑用于自动质粒制备,并同时结合到谷氨酸棒杆菌中。纯化的质粒用于测序作为最终的质量控制。之后,筛选自动构建的菌株以表征改变的特性。最重要的是,每个单元操作都被设计为独立的,因此可以在脱离工作流程时使用。

自动化单元操作由低成本液体处理设备 Opentrons OT-2 和基于前面描述的 Tecan EVO 200 的更复杂的液体处理平台执行或支持。(23,24)这两个系统有着根本的不同:OT-2 使用两个带一次性吸头的空气置换移液器。可用移液器的容量范围与手动移液器相似,操作员必须选择适合实验的移液器。它没有机械手;因此,它不能改变平板的位置,例如,将平板放在加热块上或离心机中。平台最多可容纳九个微量滴定板。本研究使用的模型没有配备冷却实验室器皿的选项。设计并 3D 打印了一个可装满冰和接头适配器的定制冷却架(参见支持信息) ,以便在必要时(例如,用于 Gibson 组装)冷却试剂。本研究中使用的配置中的 EVO 200 有一个基于液体的液体处理系统,容量范围为 3 至 990 μL。它配备了一台离心机、一个冷却载体和一个加热器/振动装置,两者都可供集成的机器人操纵臂使用。根据所用的载体,该平台可以容纳 15 个或更多的微量滴定板。为了将细菌培养物点到 100 毫米圆形培养皿上,我们设计了一个定制适配器并进行了 3D 打印(参见支持信息)。
决定使用两种不同的液体处理系统是出于最高效利用实验室设备的需求:只要有可能,就使用 OT-2 进行单元操作。与更昂贵的 EVO 200 相比,这节省了时间,因此可用于要求更高的实验。在本研究中,单元操作“菌落采摘”是手动完成的。它可以通过专用设备自动完成,但当时没有这些设备。
基于转录因子的生物传感器的合理组合设计为了证明我们的工作流程的适用性,设计、构建并在谷氨酸棒杆菌中表达了不同版本的 Lrp 生物传感器。Lrp 生物传感器将细胞内l -蛋氨酸、l -亮氨酸、l -异亮氨酸和l -缬氨酸浓度与荧光报告蛋白 eYFP 的表达相结合。为了构建不同版本的 Lrp 生物传感器,对传感器的不同部分进行了修改。Lrp 生物传感器由lrp基因(编码 Lrp 转录因子)、发散表达的eyfp基因(编码荧光报告基因)和基因间区(包含lrp启动子和eyfp上游的brnF启动子以及eyfp RBS)组成(19)(图2 )针对lrp起始密码子和 RBS、brnF启动子和eyfp RBS设计了不同的变体。
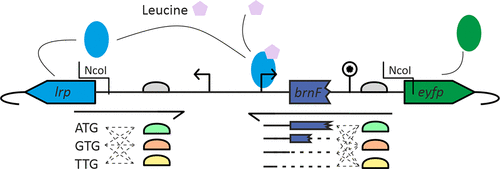
对于lrp起始密码子,选择了三种变体:天然起始密码子 ATG(应导致最高表达)、起始密码子 GTG(应导致较低表达)和 TGT(应导致非常低或无表达)。这些起始密码子变体中的每一个都与三种不同的lrp RBS 组合,同样从最高表达到最低表达:GCTAAAATGG(最强)、GCTATTGTGC(天然,较弱)和 CAATCCTACC(最弱)。lrp侧的三个起始密码子和三个 RBS 的组合产生了 3 × 3 = 9 种不同的引物。
eyfp基因在brnF启动子的控制下表达,该启动子含有 Lrp 蛋白的结合位点。(25)因此,当启动子序列缩短或延长时,可以添加或移除结合位点。由于brnF转录为无前导转录本,并且brnF的第一部分可能具有调控功能,(26)标准Lrp传感器的eyfp启动子包含brnF的前30bp 。本研究设计了四种不同的变体,从+30(标准Lrp生物传感器启动子)开始,以15为步长设计缩短版本,即+15、0和−15。对于eyfp的RBS,选择了三种变体:AAAAGGAGAT(最强)、AGAAGGAGAT(天然,强度较低)和ATCCGACCAT(最弱)。四种启动子长度和eyfp侧三种RBS的组合产生了4×3=12种不同的引物。这种设计策略总共包括9×12=108种不同的Lrp生物传感器变体。
每种变体都可以通过单个 PCR 反应构建,并且所有 PCR 反应都可以使用相同的 PCR 模板,即质粒 pJC1- lrp - brnF′ - eyfp。为了组装生物传感器质粒,每个 PCR 反应之后都会进行双片段 Gibson 组装,其中 PCR 产物被组装到 pEC-Tmob18- lrp - eyfp主链中;所有 PCR 产物都经过设计,因此它们可以组装到相同的主链中。
大肠杆菌的DNA组装与转化
在构建 Lrp 生物传感器变体之前,通过将lrp和eyfp插入可移动的 pEC-Tmob18 骨架来构建骨架质粒。在两个基因之间插入一个包含两个 NcoI 限制位点的短间隔区。此序列允许质粒线性化,并在下一步中插入包含不同lrp起始密码子、lrp RBS、brnF启动子长度和eyfp RBS 的不同版本的序列变体。
108 种变体中,96 种被选为自动克隆工作流程的应用示例,因为大多数自动化设备都是为 96 孔多滴定板设计的。PCR 变体构建、Gibson 组装和大肠杆菌热休克转化连续进行。Opentrons OT-2 能够在 85 分钟内自动移液 96 个 PCR 反应,然后将平板手动转移到热循环仪中。热循环后,使用 OT-2 混合 96 个 Gibson 组装反应,这需要 50 分钟。通过手动将平板转移到热循环仪进行孵育。在 50 °C 孵育步骤之前对 Gibson 主混合物进行适当冷却至关重要;否则,就无法获得大肠杆菌转化子。在我们的工作流程中,冷却是通过将所有实验室器皿放入装满冰的 3D 打印小盒子中实现的。大肠杆菌热休克转化是在 TECAN EVO200 液体处理机器人上进行的,该机器人实现了完全无人操作的过程,从 Gibson 组装混合物和感受态细胞开始,到将细胞点在琼脂板上准备过夜孵育结束。这个过程耗时 170 分钟。总共在 8 小时内完成了 96 个构建体的 PCR、Gibson 组装和转化,仅需 40 分钟的手动操作时间。
实施热激步骤的合适方法是将 V 型底 96 孔板放在加热装置上预热,将 8 种细胞-质粒混合物从冷却载体一次一个地转移到加热板上,孵育 30 秒,然后将其转移回冷却载体。虽然将整个板从冷却载体转移到加热装置更快,但这会产生不太可靠的热传递结果。通过离心浓缩细胞悬浮液,将其重新悬浮在 LB 培养基中,然后点在琼脂板上,即通过在单个琼脂板的同一行上移取 6 个 5 μL 的点。
此外,使用大肠杆菌感受态细胞(NEB 5-alpha 感受态大肠杆菌)和 pUC19 标准载体测试了热休克转化的参数。测试了热休克温度(37、42 和 47 °C)和热休克持续时间(0 到 30 秒,步长为 5 秒)。令人惊讶的是,在每种条件下都成功转化的情况下,菌落形成单位几乎没有差异。最终,选择了与标准手动程序最相似的条件。
经验丰富的服务团队和强大的生产支持团队为客户提供无忧的订单服务。

简体中文

繁體中文

English

日本語

한국인