Flex应用专题 | 解锁蛋白质谱前处理自动化的无限潜能
看詳情-
文章 · 2025年3月9日
清洗微孔板的具体步骤是什么
閱讀全文 -
文章 · 2025年56月8日
磁珠分选是什么
閱讀全文 -
新聞稿 · 2025年40月8日
云端相约 | 邀您共同解锁蛋白质谱前处理自动化无限潜能
閱讀全文
現代數據分析方法(例如最佳化演算法或深度學習)已成功應用於許多生物技術和醫學問題。為了使這些方法有效,需要進行大量高品質且可重複的實驗,這需要高度自動化。在這裡,我們介紹了一種開源硬體和低成本框架,可以自動高通量產生大量細胞生物學數據。我們的設計包括一個落射螢光顯微鏡,該顯微鏡帶有自動 XY 載物台,用於移動裝有細胞的多孔板,以及一個灌注歧管,允許編程應用多達八種不同的溶液。我們的系統非常靈活,可以輕鬆適應個人實驗需求。為了證明該系統的實用性,我們已使用它進行高通量 Ca 2+成像和大規模螢光標記實驗。
介紹過去十年發展的深度學習和人工神經網路 (ANN) 已被證明可用於影像分析、優化任務和機器人技術(LeCun 等人,2015 年;Hinton,2018 年;Hinton 等人,2019 年)。它們在解決生物問題方面也越來越受歡迎。例如,基於 ANN 的細胞分割演算法比傳統方法更準確、更快(Hilsenbeck 等人,2017 年)。深度學習也有助於檢測人體組織中的轉化細胞(Van Valen 等人,2016 年;Coudray 等人,2018 年)、優化治療條件(Kusumoto 和Yuasa,2019 年)以及解釋動物行為(Heras 等人, 2019 年)。最近,已經開發了一個線上平台,讓沒有任何深度學習知識的研究人員可以在自己的應用程式中使用它(von Chamier 等人,2020 年),進一步提高了深度學習作為分析工具的實用性。
在應用深度學習和其他機器學習方法時,一個重要的考慮因素是訓練資料集的大小。通常,深度學習需要數千到數萬個數據點(O'Mahony 等人,2019 年)。這在生物實驗中通常是不可行的,因為它們通常需要很長時間才能完成。因此,需要能夠在最少的人工監督下執行數百或數千個實驗的自動化系統。這種自動化系統應允許(a) 在多個孔中進行單細胞顯微鏡檢查(明場和/或螢光)(即具有XY 載物台);(b) 自動應用多種不同的解決方案;(c ) 自動線上分析(例如,細胞分割和平均亮度的計算)。
市售螢光顯微鏡(例如 Olympus BX61、Nikon Ti Widefield 或 Nikon A1 共聚焦系統,以及活細胞成像系統,例如 Echo Revolve 或 Sartorius Incucyte)通常配備 XY 載物台,可進行多孔螢光成像。然而,這些系統價格昂貴(15,000-150,000 英鎊),並且僅提供有限的自動化解決方案應用功能。許多市售系統(例如 Hamilton 或 Andrew)都允許這樣做,但由於其尺寸和成本,這些系統很難與即時成像相結合。
3D 列印以及 Arduino 和 Raspberry Pie 等廉價電子設備的發展引發了定制經濟實惠的科學設備的革命,而這些設備以前只能在大型實驗室或大學設施中使用。這些設備不僅經濟實惠,而且可以根據各個實驗室的需求進行客製化。此類技術的一個例子是Baden 等人(2015 年)和Maia Chagas 等人(2017 年)開發的labware.net,它允許3D 列印極其便宜的實驗室設備,從標準可用的微量移液器和微操作器到螢光顯微鏡和光遺傳學解決方案。
最近開發了幾種開源高品質顯微鏡。例如,Diederich 等人 (2020)開發了一個可自訂的 3D 列印開源框架,可用於建立各種顯微鏡:從具有自動對焦功能的簡單明場顯微鏡到具有樣品光學切片功能的更複雜的系統。然而,這些資源缺乏用於掃描大量樣本的開源系統。 Sharkey 等人(2016)針對小動作解決了這個問題,Merces 等人 (2021)針對多孔板的穩健成像解決了這個問題。然而,這些解決方案不提供任何細胞操作,儘管最近已經開發了開源液體處理解決方案(例如,Wijnen 等人,2014 年;Almada 等人,2019 年;Amarante 等人,2019 年;Booeshaghi 等人,2019年;Samokhin,2020 年;Baas 和Saggiomo,2021 年)。
在這裡,我們介紹了一個開源系統,該系統結合了多孔板中的高通量顯微鏡、自動化溶液應用、同步螢光成像和影像分析。它成本低(不含螢光顯微鏡的價格為400-600 英鎊,帶螢光顯微鏡的價格為2,500 英鎊),完全可定制,並且最多可以連續進行96 或384 個實驗,如果實驗不需要高採樣率(例如每分鐘1 幀或更高),則可以同時進行。該平台配備一個單通道落射螢光顯微鏡頭,可用於對動態螢光報告基因(例如 GCaMP 和合成鈣染料;Razlivanov 等人,2018 年)和/或用螢光抗體或染料標記的樣本進行成像。我們展示了我們的系統如何在嚴格控制和可重複的實驗條件下大規模快速產生細胞生物數據。
結果典型的細胞生物學實驗範例通常涉及用生物活性化合物(例如生長因子、鈣動員激動劑和細胞毒性劑)處理細胞,並使用螢光報告基因監測細胞行為或固定細胞以便隨後進行免疫螢光標記或基因表達分析。為了使此類實驗自動化,我們開發了一個實驗平台,該平台允許自動對 96 孔板進行成像並使用注射幫浦應用八種溶液。我們首先介紹該平台並展示其適用性,然後更詳細地描述硬體、軟體和系統效能。
自動化平台及其適用性完整組裝的系統如圖1A所示。硬體由幾個主要模組組成:水平移動多孔板的XY 平台;帶有自動對焦系統的小型螢光顯微鏡(補充影片1);以及將八種溶液應用到各個孔中的灌注歧管(補充影片2) 。建置說明和所有 3D 列印文件可在https://github.com/frescolabs/FrescoM取得(另請參閱補充文字)。可以使用 Python 編寫的用戶界面操作硬體(圖 1B,有關詳細信息,請參閱“軟體”部分),該界面控制平台、物鏡和歧管以及自動對焦、曝光、照明和實驗方案的整體管理。
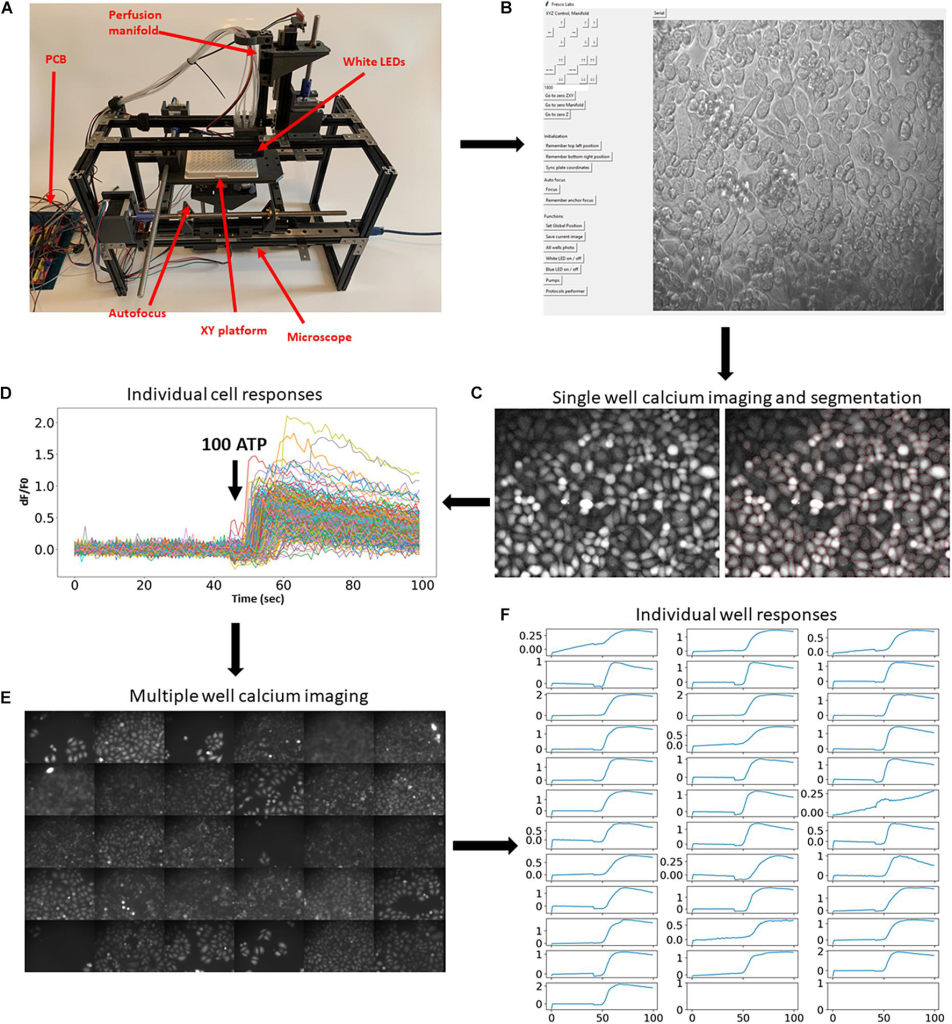
為了展示該平台,我們首先展示了它如何用於大規模螢光成像實驗(Nasu et al., 2021)。涉及螢光報告基因的典型實驗方案需要在應用激動劑、生長因子或其他活性化合物之前和之後對細胞進行一段時間的成像。為了證明所開發的實驗平台對這種實驗範式的可用性,我們使用合成的鈣濃度螢光指示劑進行了鈣成像。細胞自動以螢光鈣染料 Fluo4-AM 標記(圖 1C),並響應 100 μm ATP 進行鈣成像。接著使用 Cellpose 演算法(Stringer et al., 2021 )自動分割細胞(圖 1C ,右) ,並擷取單一細胞的螢光動力學(圖 1D)。然後在其他 30 個孔中自動重複相同的實驗程序和分析(圖 1E、F和補充影片 3)。這些實驗表明,開發的平台可以實現螢光報告基因的穩健和自動高通量成像。
所開發系統的另一個重要優勢是它允許在大量孔中大規模生成影像。 為了證明這種可用性,我們產生了一個Python 協議類(補充協議1,有關詳細信息,請參閱“軟體”部分),使平台在所有96 個孔上移動,對每個細胞進行聚焦,並捕獲明場或螢光影像。 此類實驗的示例如圖2A、B所示。 重要的是,該系統允許掃描單個孔並對同一個孔生成多張圖像(圖2C),這對於尋找稀有細胞(例如,正在進行有絲分裂/凋亡的細胞或轉染效率低下的陽性細胞)很有用。

為了證明所開發的實驗平台在標記實驗中的可用性,我們使用了螢光小麥胚芽凝集素 (WGA),該物質可突出顯示細胞膜。用 PBS 自動清洗五排孔(共 48 個孔),然後加入含有 5 mg/ml 螢光 WGA 的溶液。室溫放置 10 分鐘後,用 PBS 清洗 WGA,然後放入螢光顯微鏡下觀察。所得的螢光影像如圖2D所示。自動標記可產生具有明確質膜的細胞的清晰圖像,從而表明可以使用所開發的平台自動執行常規標記程序。
最後,我們也測試了所開發的平台是否可用於以抗 HER2 抗體(Herceptin)為一抗、以 Alexa 488 偶聯的二抗進行免疫螢光染色。以 PBS 和 Herceptin 自動灌注含有 SKBR3 細胞(HER2 高表達)或 HeLa 細胞(HER2 低表達)的孔。室溫下孵育 40 分鐘後,用 PBS 灌注細胞,然後用二抗體灌注。室溫下再孵育 30 分鐘後,以成像溶液灌注孔並進行螢光成像(圖 2E和補充圖 1)。所得的影像顯示,HER2 水平高的 SKBR3 細胞的細胞膜標記清晰,但受體水平低的 HeLa 細胞的細胞膜標記不清晰,從而證明了自動標記程序的穩健性。
這些範例證明了所開發的實驗平台在不同類型的細胞生物學實驗自動化方面的廣泛可用性。下面,我們將詳細描述該平台並在一系列測試中展示其性能。
硬體設計整體結構由 MakerbeamXL 15 毫米 × 15 毫米擠壓件構成,透過 L 型和 T 型鋁製支架或 3D 列印零件連接。我們發現使用鋁擠壓框架代替完全 3D 列印零件(兩種型號均可在https://github.com/frescolabs/FrescoM上找到)可以使整個系統更穩定並減少振動(未顯示數據)。框架由八個側面擠壓件組成(四個垂直 300 毫米和三個水平 200 毫米,兩個在頂部,一個在底部,圖 3A)。側面與兩個 400 毫米擠壓件相連,用於固定驅動x軸的 MGH12 導軌。 y軸(圖 3B)位於由四個 200 毫米擠壓件構成的方形框架上,並透過兩個 3D 列印支架連接到x軸。兩個 MGH12 導軌位於框架上,可容納一個 Nema 17 馬達和一個 96 孔板支架(圖 3B,y_plate_holder.stl 檔案)。
經驗豐富的服務團隊和強大的生產支援團隊為客戶提供無憂的訂單服務。