Flex应用专题 | 解锁蛋白质谱前处理自动化的无限潜能
看詳情-
文章 · 2025年56月8日
磁珠分选是什么
閱讀全文 -
新聞稿 · 2025年40月8日
云端相约 | 邀您共同解锁蛋白质谱前处理自动化无限潜能
閱讀全文 -
文章 · 2025年27月6日
微孔板振荡器在工作站中的应用
閱讀全文
分子克隆是合成生物學的核心,因為它包括 DNA 的組裝及其在目標宿主中的表現。然而,目前克隆通常是一個手動、耗時且重複的過程,自動化將極大地促進此過程的發展。完整的合理克隆過程(即從 DNA 創建到在靶宿主中表達)的自動化涉及不同操作和機器的整合。這類工作流程的範例很少,尤其是當設計合理(即DNA 序列設計是固定的,而不是基於隨機庫)且目標宿主在遺傳上不太易於處理(例如,對熱休克轉化不敏感)時。在本研究中,介紹了一種自動化工作流程,用於合理構建質粒並將其隨後接合轉移到生物技術平台生物谷氨酸棒狀桿菌中。整個工作流程都配有客製化的軟體工具。作為應用範例,建構並表徵了基於調節器 Lrp 的合理設計的轉錄因子生物感測器庫。獲得了具有改進的動態範圍的傳感器,並且從篩選中獲得的見解為谷氨酸棒桿菌Lrp的雙重調節功能提供了證據。
介紹大宗和精細化學品的微生物生產是實現更永續的全球經濟的重要組成部分。為了促進這一發展,必須提高對微生物生命的基本理解及其工程設計以滿足社會需求。近年來,人們提出了採用設計-建構-測試-學習 (DBTL) 循環作為實現這一目標的工具。 (1)分子克隆在這一循環中發揮重要作用,因為它可以產生具有不同特性的新基因型以供探索。目前已開發出多種軟體工具來幫助進行基因型的電子克隆,其數量很容易超過實驗室中手動克隆的數量。 (2)現在,在短時間內設計數百種基因型已成為可能。例如,一條由 5 個基因組成的生產途徑,每個基因具有 3 個不同的核醣體結合位點 (RBS),已經產生了 3 5 = 243 種變體。然而,這種項目的設計相對簡單,現在瓶頸轉移到實際體外創建這些序列及其在所需工業宿主中的表現。 (3)可以透過使用一鍋組裝和篩選方法來解決該問題,即獲得許多但不一定是全部的變體,並使用篩選試驗來選擇表現最佳的變體。 (4)然而,這些方法有一個缺點:知識僅來自成功建造並從一鍋反應中分離的少數變體。較難建構的變體在這種反應中較少,因此不太可能篩選出它們的特性。對於許多基本的生物學問題,這不是一個理想的解決方案。在這裡,合理的菌株構建和工作流程所有步驟內所有品種的完整可追溯性是必要的,就像經典分子克隆所實現的那樣。然而,目前分子克隆通常是一個手動、耗時且重複的過程,自動化將為其帶來巨大好處。 (5)合理克隆工作流程的自動化具有多種好處。實驗人員在菌株構建上花費的動手時間可以大大減少。再加上可以實現更高的吞吐量,這大大增加了可以及時生產的構建體的數量。此外,自動化透過消除過程中的隨機變化引入了流程的標準化。這些過程也可以更容易監控和分析,從而更容易找到改進的空間。因此,自動化可以提高克隆工作流程的數量和品質。近年來,微流體技術已用於實現克隆過程的自動化。 (6,7)在這裡,客製化的微流控晶片用於為單一單元操作提供液體分離和液體轉移。雖然這種技術具有將許多單元操作組合在一個設備中的優勢,並且能夠擴展到每個晶片進行大量實驗,但需要高度專業的基礎設施和人員來製造晶片並進行實驗。更模組化、更方便的解決方案是使用標準液體處理系統,如果需要,也可以使用輔助設備。這樣的系統可能相當複雜,能夠執行大量具有不同任務的實驗,(8−11)而且還有更具成本效益的解決方案可供選擇。 (12)最近提出的策略利用特定細菌的自然轉化能力,從而產生一種高效且易於使用的克隆方法。 (13)然而,這種方法僅限於少數主動吸收外源 DNA 的生物。迄今為止發布的大多數自動克隆工作流程都集中於大腸桿菌。 (14)大腸桿菌是一種成熟的分子克隆宿主,在遺傳學上非常容易操控。許多遺傳工具已被開發和優化用於大腸桿菌,並且有全面的組學數據可用。然而,由於大腸桿菌的低壓力耐受性和噬菌體感染風險,它並不總是工業過程的理想宿主。 (15)因此,擴展自動化平台以涵蓋對其他遺傳上較難處理的微生物進行工程改造將是有益的。谷氨酸棒狀桿菌是一種廣泛使用的工業細菌(16)由於其對熱休克轉化等自動化友好轉化過程具有抵抗力,因此其改造難度比大腸桿菌更大。雖然已經朝這個方向採取了一些措施,(17)它們通常無法實現實際目標生物轉化過程的自動化,最常見的原因是,電穿孔(針對此類生物的首選方法)不易實現自動化。本研究提出了一個完整的工作流程,用於自動化合理地建構抗熱休克微生物菌株。所有工作均使用標準液體處理系統進行。 PCR 和 Gibson 組裝用於建立 96 個質粒的文庫。開發了大腸桿菌熱休克轉化的自動化方案作為穿梭系統。菌落 PCR 和定序用作品質控制。對於轉化谷氨酸棒桿菌的最後一步,開發了一種新穎的高通量接合工作流程。接合是一種描述良好且高度相關的細菌轉化技術。 (18)這種方法效率很高,但由於需要使用瓊脂板和濾紙,因此通常比較費力。在本研究中,我們透過使用離心法簡化了操作並使其自動化。整個工作流程都配有一個客製化的軟體工具,用於追蹤所有構建體及其在流程中的狀態。作為應用範例,顯示了谷氨酸棒桿菌中不同 Lrp 生物感測器變體的組裝和表達。 Lrp 生物感測器先前已開發用於檢測谷氨酸棒桿菌中的l -蛋氨酸和支鏈氨基酸。 (19)此感測器將細胞內l -蛋胺酸和支鏈胺基酸濃度與eyfp的表達結合,後者編碼一種螢光報告蛋白。細胞內濃度增加會導致螢光訊號增強。一般而言,生物感測器的設計相對模組化;可以透過修改核醣體結合位點和啟動子長度等來改變其特性。 (20,21)此外,透過設計,它們提供了基因型和表型之間的直接且易於測量的關係;即Lrp 感測器設計的變化可能會導致不同的可測量螢光輸出。因此,選擇不同 Lrp 生物感測器的合理設計作為應用範例,以展示我們的克隆自動化方法的優勢。
結果與討論自動化基因工程工作流程本研究開發的自動克隆工作流程(圖1)可分為兩個階段:質粒在大腸桿菌中的組裝和擴增以及將質粒轉移到目標生物體(本例中為谷氨酸棒桿菌)中。質粒的建構是透過電腦設計零件、透過 PCR 建構片段以及透過 Gibson 組裝整合到骨架載體中。之所以選擇 Gibson 組裝,是因為它允許質粒無疤痕組裝。 (22)隨後經由熱休克轉化為大腸桿菌。將所得克隆透過冷凍保存,並透過菌落 PCR 進行第一步品質控制。之所以選擇這種方法,是因為其成本效益高且運行時間短。此菌落PCR 的結果影響了接下來的步驟:只有菌落PCR結果為陽性的大腸桿菌克隆,即所得的DNA 片段具有預期大小,顯示片段成功組裝到主鏈中,才會被考慮用於自動質粒製備,並同時結合到谷氨酸棒桿菌中。純化的質粒用於定序作為最終的品質控制。之後,篩選自動建構的菌株以表徵改變的特性。最重要的是,每個單元操作都被設計為獨立的,因此可以在脫離工作流程時使用。

自動化單元操作由低成本液體處理設備 Opentrons OT-2 和基於前面描述的 Tecan EVO 200 的更複雜的液體處理平台執行或支援。 (23,24)這兩個系統有著根本的不同:OT-2 使用兩個帶有一次性吸頭的空氣置換移液器。可用移液器的容量範圍與手動移液器相似,操作員必須選擇適合實驗的移液器。它沒有機械手;因此,它不能改變平板的位置,例如,將平板放在加熱塊上或離心機中。平台可容納多達九個微量滴定板。本研究使用的模型沒有配備冷卻實驗室器皿的選項。設計並 3D 列印了一個可裝滿冰和接頭適配器的定製冷卻架(請參閱支援資訊) ,以便在必要時(例如,用於 Gibson 組裝)冷卻試劑。本研究中使用的配置中的 EVO 200 有一個基於液體的液體處理系統,容量範圍為 3 至 990 μL。它配備了一台離心機、一個冷卻載體和一個加熱器/振動裝置,兩者都可供整合的機器人操縱臂使用。根據所使用的載體,該平台可容納 15 個或更多的微量滴定板。為了將細菌培養物點到 100 毫米圓形培養皿上,我們設計了一個客製化適配器並進行了 3D 列印(請參閱支援資訊)。決定使用兩種不同的液體處理系統是出於最高效利用實驗室設備的需求:只要有可能,就使用 OT-2 進行單元操作。與更昂貴的 EVO 200 相比,這節省了時間,因此可用於要求更高的實驗。在本研究中,單元操作「菌落採摘」是手動完成的。它可以透過專用設備自動完成,但當時沒有這些設備。基於轉錄因子的生物感測器的合理組合設計為了證明我們的工作流程的適用性,設計、建構並在谷氨酸棒桿菌中表達了不同版本的 Lrp 生物感測器。 Lrp 生物感測器將細胞內l -蛋氨酸、l -亮氨酸、l -異亮氨酸和l -纈氨酸濃度與螢光報告蛋白 eYFP 的表達相結合。為了建構不同版本的 Lrp 生物感測器,對感測器的不同部分進行了修改。 Lrp 生物感測器由lrp基因(編碼Lrp 轉錄因子)、發散表達的eyfp基因(編碼螢光報告基因)和基因間區(包含lrp啟動子和eyfp上游的brnF啟動子以及eyfp RBS)組成(19)(圖2 )針對lrp起始密碼子和RBS、brnF啟動子和eyfp RBS設計了不同的變體。
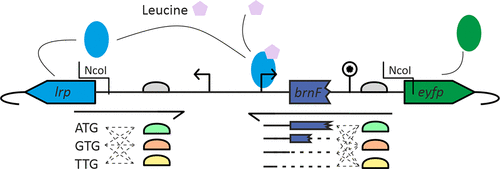
對於lrp起始密碼子,選擇了三種變體:天然起始密碼子ATG(應導致最高表達)、起始密碼子GTG(應導致較低表達)和TGT(應導致非常低或無表達) 。這些起始密碼子變體中的每一個都與三種不同的lrp RBS 組合,同樣從最高表達到最低表達:GCTAAAATGG(最強)、GCTATTGTGC(天然,較弱)和 CAATCCTACC(最弱)。 lrp側的三個起始密碼子和三個 RBS 的組合產生了 3 × 3 = 9 種不同的引子。 eyfp基因在brnF啟動子的控制下表達,該啟動子含有 Lrp 蛋白的結合位點。 (25)因此,當啟動子序列縮短或延長時,可以添加或移除結合位點。由於brnF轉錄為無前導轉錄本,且brnF的第一部分可能具有調控功能,(26)標準Lrp感測器的eyfp啟動子包含brnF的前30bp 。本研究設計了四種不同的變體,從+30(標準Lrp生物感測器啟動子)開始,以15為步長設計縮短版本,即+15、0和−15。對於eyfp的RBS,選擇了三種變體:AAAAGGAGAT(最強)、AGAAGGAGAT(天然,強度較低)和ATCCGACCAT(最弱)。四種啟動子長度和eyfp側三種RBS的組合產生了4×3=12種不同的引子。這種設計策略總共包括9×12=108種不同的Lrp生物感測器變體。每種變體都可以透過單一 PCR 反應構建,所有 PCR 反應都可以使用相同的 PCR 模板,即質粒 pJC1- lrp - brnF′ - eyfp。為了組裝生物感測器質粒,每個PCR 反應之後都會進行雙片段Gibson 組裝,其中PCR 產物被組裝到pEC-Tmob18- lrp - eyfp主鏈中;所有PCR 產物都經過設計,因此它們可以組裝到相同的主鏈中。
大腸桿菌的DNA組裝與轉化在建構 Lrp 生物感測器變體之前,透過將lrp和eyfp插入可移動的 pEC-Tmob18 骨架來建構骨架質粒。在兩個基因之間插入一個包含兩個 NcoI 限制性位點的短間隔區。此序列允許質粒線性化,並在下一步中插入包含不同lrp起始密碼子、lrp RBS、brnF啟動子長度和eyfp RBS 的不同版本的序列變體。 108 種變體中,96 種被選為自動克隆工作流程的應用範例,因為大多數自動化設備都是為 96 孔多滴定板設計的。 PCR 變異建構、Gibson 組裝和大腸桿菌熱休克轉化連續進行。 Opentrons OT-2 能夠在 85 分鐘內自動移液 96 個 PCR 反應,然後將平板手動轉移到熱循環儀中。熱循環後,使用 OT-2 混合 96 個 Gibson 組裝反應,這需要 50 分鐘。透過手動將平板轉移到熱循環儀進行孵育。在 50 °C 孵育步驟之前對 Gibson 主混合物進行適當冷卻至關重要;否則,就無法獲得大腸桿菌轉化子。在我們的工作流程中,冷卻是透過將所有實驗室器皿放入裝滿冰的 3D 列印小盒子中實現的。大腸桿菌熱休克轉化是在 TECAN EVO200 液體處理機器人上進行的,該機器人實現了完全無人操作的過程,從 Gibson 組裝混合物和感受態細胞開始,到將細胞點在瓊脂板上準備過夜孵育結束。這個過程耗時 170 分鐘。總共在 8 小時內完成了 96 個構建體的 PCR、Gibson 組裝和轉化,僅需 40 分鐘的手動操作時間。實施熱激步驟的合適方法是將V 型底96 孔板放在加熱裝置上預熱,將8 種細胞-質粒混合物從冷卻載體一次一個地轉移到加熱板上,孵育30 秒,然後將其轉移回冷卻載體。雖然將整個板從冷卻載體轉移到加熱裝置更快,但這會產生較不可靠的熱傳遞結果。透過離心濃縮細胞懸浮液,將其重新懸浮在 LB 培養基中,然後點在瓊脂板上,即透過在單一瓊脂板的同一行上移取 6 個 5 μL 的點。此外,使用大腸桿菌感受態細胞(NEB 5-alpha 感受態大腸桿菌)和 pUC19 標準載體測試了熱休克轉化的參數。測試了熱休克溫度(37、42 和 47 °C)和熱休克持續時間(0 到 30 秒,步長為 5 秒)。令人驚訝的是,在每種條件下都成功轉化的情況下,菌落形成單位幾乎沒有差異。最終,選擇了與標準手動程序最相似的條件。
經驗豐富的服務團隊和強大的生產支援團隊為客戶提供無憂的訂單服務。