Flex应用专题 | 解锁蛋白质谱前处理自动化的无限潜能
看詳情-
文章 · 2025年3月9日
清洗微孔板的具体步骤是什么
閱讀全文 -
文章 · 2025年56月8日
磁珠分选是什么
閱讀全文 -
新聞稿 · 2025年40月8日
云端相约 | 邀您共同解锁蛋白质谱前处理自动化无限潜能
閱讀全文
在生物化學與分子生物學的廣泛領域中,蛋白質純化是一項至關重要的技術,它旨在從紛繁複雜的生物樣本中精準地提取並純化單一的目標蛋白質。此過程不僅要求高度的精確性,還需考慮蛋白質的物理化學特性及其生物活性保護。為了更快速、方便的蛋白質進行純化處理,科學家研究出了各種蛋白質的提純方法:
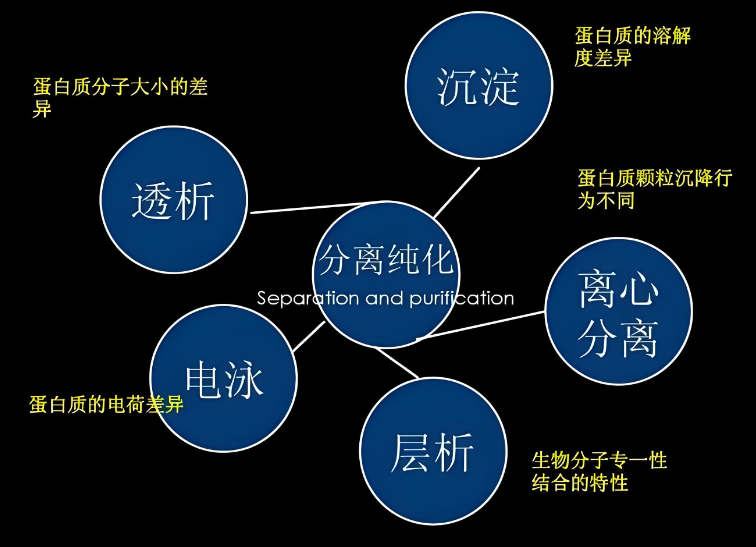
一、鹽析法
原理:鹽析法是透過在蛋白質溶液中加入高濃度的中性鹽(如硫酸銨、硫酸鈉等),使蛋白質在水中的溶解度降低而沉澱析出。鹽解離產生的離子會爭奪溶液中大部分自由水,從而破壞蛋白質的水化作用,降低其溶解度,進而造成蛋白質沉澱。此外,鹽分的解離還可抑制蛋白質弱電解質的解離,使蛋白質帶電荷減少,更容易聚集析出。
二、透析及超濾法
原理:
1.透析:利用僅能通透小分子化合物的半透膜,使大分子蛋白質與小分子化合物(如鹽類、小分子代謝物等)分離,達到濃縮蛋白質或去除小分子雜質的目的。
2.超濾:在一定的壓力下,使小分子溶質和溶劑穿過一定孔徑的特製薄膜(超濾膜),而大分子溶質(如蛋白質)則被截留,從而實現蛋白質的初步濃縮和純化。
三、電泳法
原理:蛋白質在電場中會因為所帶電荷和分子量的不同而發生遷移,形成不同的電泳帶。透過調整電泳條件(如電場強度、緩衝液pH值等),可以實現蛋白質的分離和純化。常用的電泳方法包括SDS-聚丙烯醯胺凝膠電泳(SDS-PAGE)、等電聚焦電泳和雙向凝膠電泳等。
四、層析法(色譜法)
原理:層析法是利用各蛋白質分子在固定相和流動相之間的分配係數不同而實現分離的方法。根據分離原理的不同,層析法可分為多種類型,包括:
1.凝膠過濾(分子篩層析):基於蛋白質分子大小的差異進行分離。層析管內填充帶小孔的顆粒(如葡聚醣凝膠),小分子蛋白質可進入顆粒內部,而大分子蛋白質則不能,因此不同分子量的蛋白質在層析柱內的滯留時間不同,從而實現分離。
2.離子交換層析:依蛋白質的電荷差異進行分離。層析管內填充帶電樹脂,蛋白質與樹脂發生電荷交換,透過改變緩衝液的離子濃度或pH值,實現蛋白質的分離。
3.親和層析:利用目標蛋白與某種特定親和劑(如抗體、配體、金屬離子等)之間的高親和性進行分離。親和劑固定在層析柱上,目標蛋白與親和劑結合後被保留在柱上,透過改變洗脫條件(如pH值、添加特定配體等),使目標蛋白脫附並收集。
五、超速離心法
原理:根據蛋白質的密度和形態差異進行分離。在超速離心力的作用下,不同密度和形態的蛋白質會在離心管中形成不同的沉降帶,從而實現分離。超速離心法常用於分離不同大小和密度的細胞器以及亞細胞組分中的蛋白質。
六、其他方法
除了上述方法外,還有等電點沉澱法、有機溶劑沉澱法、逆流層析法、疏水相互作用層析法等多種蛋白質純化方法。這些方法各有優缺點,適用於不同類型的蛋白質純化需求。
蛋白質純化是一個複雜而精細的過程,需要根據目標蛋白質的性質和實驗需求選擇合適的純化方法或組合多種方法進行逐步純化。透過不斷優化純化條件和技術手段,可以獲得高純度、高活性的目標蛋白質,為後續的生物學研究和應用提供有力支持。
經驗豐富的服務團隊和強大的生產支援團隊為客戶提供無憂的訂單服務。