Flex应用专题 | 解锁蛋白质谱前处理自动化的无限潜能
看詳情-
文章 · 2025年3月9日
清洗微孔板的具体步骤是什么
閱讀全文 -
文章 · 2025年56月8日
磁珠分选是什么
閱讀全文 -
新聞稿 · 2025年40月8日
云端相约 | 邀您共同解锁蛋白质谱前处理自动化无限潜能
閱讀全文
已經評估了兩種用於從鼻咽拭子中高通量提取 RNA 以檢測 SARS-CoV-2 的自動化內部協議。
在 10 天內收集了 141 個 SARS-CoV-2 陽性樣本。內部協議基於磁珠提取,設計用於Opentrons OT-2(OT-2內部)液體處理機器人或MagMAX TM Express-96 系統(MM內部)。兩種協議均與使用 MagMAX TM系統(MM試劑盒)的商業試劑盒並行測試。核酸萃取效率是根據 SARS-CoV-2 DNA 陽性對照計算的。
在檢測陽性樣本方面,內部方案和商用試劑盒之間沒有發現顯著差異。 MM 試劑盒效率最高,儘管內部 MM 試劑盒的平均 Ct 值低於其他兩種試劑盒。與商用試劑盒相比,內部方案每萃取 96 個樣本可節省 350 歐元至 400 歐元。
所述協議利用易於取得的試劑和開源液體處理系統,適用於高通量設施中的 SARS-CoV-2 檢測。
引用: Lázaro-Perona F、Rodriguez-Antolín C、Alguacil-Guillén M、Gutiérrez-Arroyo A、Mingorance J、García-Rodriguez J 等人。 (2021)評估兩種用於 SARS-CoV-2 檢測的自動化低成本 RNA 萃取方案。 PLoS ONE 16(2): e0246302。 https://doi.org/10.1371/journal.pone.0246302
編輯: AM Abd El-Aty,埃及開羅大學
收稿日期: 2020 年11 月5 日;接受日期: 2021 年1 月15 日;發表日期: 2021 年2 月16日
版權所有: © 2021 Lázaro-Perona 等人。這是一篇開放取用的文章,根據知識共享署名授權條款分發,允許在任何媒體中不受限制地使用、分發和複製,前提是註明原作者和來源。
資料可用性:所有相關資料均在論文及其支援資訊檔案中。
資金:作者未收到此項工作的特定資金資助。
競爭利益:作者已聲明不存在競爭利益。
SARS-CoV-2 疫情要求大規模使用 qPCR 檢測,以發現陽性病例並追蹤接觸者,從而阻止社區傳播。在 qPCR 檢測之前,通常需要對臨床樣本進行 RNA 萃取 [ 1-4 ]。考慮到每天檢測的樣本數量,大多數機構無法採用手動 RNA 提取方法,因此,自動化系統被廣泛用於此任務 [ 5-7 ] 。自動化系統的缺點是,它顯著增加了最終成本,這可能會阻礙某些地區的大規模檢測。此外,由於需求增加,萃取試劑的庫存短缺導致診斷嚴重延遲。
本文介紹了兩種低成本的自動 RNA 萃取方法。第一種方法使用OT-2 系統(Opentrons,紐約州紐約市,美國),這是一種能夠自動執行自行設計方案的開源液體處理機器人;第二種方法使用快速且易於使用的核酸萃取儀MagMAX TM Express-96 系統(Thermo Fisher Scientific,麻薩諸塞州沃爾瑟姆,美國)。後者可在 30 分鐘內提取多達 96 個樣本,但需要事先手動分配試劑、磁珠和 96 孔板中的樣本,這會增加 30 分鐘。作為替代方案,OT-2內部方案可以完全自動化地在 104 分鐘內處理多達 48 個樣本。
在十天內,收集了 141 份連續的 SARS-CoV-2 陽性鼻咽拭子,這些拭子帶有病毒運輸培養基(西班牙巴塞隆納 Deltalab),並儲存在 4°C 下。處理前,將500 μL 病毒培養基和500 μL 4M 異硫氰酸胍(GTC)(德國希爾登Qiagen)與5 μg/mL 載體RNA 混合,使樣品失活,然後將樣品在80°C 下加熱2 分鐘,並短暫渦旋混合。
核酸自動萃取採用兩種系統:MagMAX TM Express-96 深孔磁粉處理器(King Fisher Instrument,Thermo Fisher Scientific,美國麻薩諸塞州沃爾瑟姆)和開放式系統OT-2( Opentrons,美國紐約州紐約),配有GEN1 磁模組(Opentrons,美國紐約州紐約)和內部協議。兩種系統均使用 MagMAX™ Express 96 板和深孔板(Thermo Fisher Scientific,美國麻薩諸塞州沃爾瑟姆)。
核酸萃取採用三種方法:1)根據製造商的說明,使用MagMAX TM和商用MagMAX CORE 核酸純化試劑盒(MM試劑盒)(Thermo Fisher Scientific,美國麻薩諸塞州沃爾瑟姆);2)OT-2 系統採用通用試劑(OT-2內部),例如乙醇(Emsure®,Merck KGaA,德國達姆施塔特)、2-丙醇(Emsure®,Merck KGaA,德國達姆施塔特)、洗脫緩衝液(Omega BIO-TEK,美國喬治亞州諾克羅斯)、無核酸酶水(Ambion TM,Thermo Fisher Scientific,美國麻薩諸塞州沃爾瑟姆)和磁珠(Mag-Bind® TotalPure NGS,Omega Bio-Tek,美國喬治亞州諾克羅斯);3)MagMAX TM採用與商用試劑盒相同的協議,但使用OT-2 方法中的試劑(MM內部)。內部協議是 Hui He 等人所描述的程序的修改版[8]。簡而言之,將滅活的呼吸道樣本以1:1 的比例與異丙醇混合,至最終體積為500 μl(內部OT-2)和1000 μL(內部MM),加入40 μL 磁珠並在室溫下孵育5 分鐘。接下來,用磁鐵將磁珠拉到管的一側並棄去上清液。然後用 500 μL 新鮮製備的 70% 乙醇洗滌磁珠兩次。第二次洗滌後,棄去 70% 乙醇並在室溫下風乾磁珠。最後,將珠子重新懸浮在 100 μL 洗脫緩衝液中並再次用磁鐵分離以回收洗脫的病毒 RNA(表1)。
表 1.所評估的三個方案中所使用的步驟、試劑和體積(μL)。
MM試劑盒協議:
MM內部協定:
OT-2內部協定:
OT-2內部協定是根據 Opentrons 說明用 Python 編寫的。腳本已存放在 GitHub 儲存庫中
為了驗證內部核酸萃取方案的性能,使用DNA 陽性對照TaqMan 2019-nCoV 對照試劑盒v1(賽默飛世爾科技,美國麻薩諸塞州沃爾瑟姆)製作了標準、低和極低病毒載量的模擬樣本。對照試劑盒的濃度為 1 x 10 4拷貝/μL。標準病毒量樣本的製備方法是將 10 μL 陽性對照與 490 μL 病毒運輸培養基和 500 μL GTC 混合。低和極低病毒量的製備方式相同,但使用陽性對照的十倍連續稀釋液。所有模擬樣本均製備三份,並與內部OT-2 、MM試劑盒和內部MM並行處理,然後使用TaqMan 2019- nCoV 檢測試劑盒v1 進行qPCR 測試。標準、低和極低病毒量的模擬樣本中陽性對照的最終濃度分別為1 x 10 6拷貝/mL、1 x 10 5拷貝/mL 和1 x 10 4拷貝/mL。所有運行均包括陰性對照。
透過將模擬樣本中陽性對照的Ct 值(Ct ss ) 與直接從庫存製備的陽性對照的Ct 值進行比較來計算核酸提取效率,校正量以匹配稀釋因子和每個方案中使用的初始樣本量(Ct pc ) (R = 2 -ΔCt = 2 -(Ctss-Ctpc) )。
使用針對orf1ab、刺突(S)、核衣殼(N) 和人類RNaseP 基因的TaqMan 2019-nCoV 檢測試劑盒v1 以及作為陽性對照的TaqMan 2019-nCoV 對照試劑盒v1,依照製造商建議的qPCR 條件對SARS-CoV-2 病毒RNA 進行核酸擴增。所有 qPCR 檢測均在 CFX96 Touch 實時 PCR 檢測系統 (Bio-Rad,美國加州赫拉克勒斯) 中進行。為了減少檢測間差異,萃取的核酸樣本使用另一個 OT-2 模組自動分配到 qPCR 試紙中。
成對比較了這三種方案。使用 McNemar 檢定來比較它們將樣本分配為陽性或陰性的表現。 Ct 值不呈常態分佈,因此使用 Wilcoxon 符號秩檢定來比較每個目標的 Ct 值。對於每個目標,僅考慮透過這三種方法擴增的樣本。使用 bootstrap 方法計算中位置信區間。
所有統計檢定均採用 IBM SPSS Statistics 24.0.0.0 軟體套件(SPSS Inc.,美國伊利諾州芝加哥)執行。
透過提取模擬不同病毒量的 SARS-CoV-2 陽性對照製備的模擬樣本,將兩種內部方案的核酸萃取效率與 MM試劑盒方案進行了比較。 MM試劑盒和OT-2內部方案成功擴增了所有具有標準病毒量的模擬樣本中的orf1ab 、S 和N 標靶。對於這些樣本,所有重複和基因的平均萃取效率為MM試劑盒33.9%(SD:13.8),OT-2內部方案19.6%(SD:2.2) ,MM內部方案16.0%(SD:5.03) 。
在低病毒量模擬樣本中,MM試劑盒無法擴增所有樣本中的S 靶標,也無法擴增其中一個重複樣本中的N 靶標,而OT-2內部和MM內部檢測出了所有基因。最後,MM試劑盒和OT-2內部方案無法擴增極低病毒量樣本,除了一個重複樣本,其中N 基因可以透過OT-2內部方案擴增,但MM內部可以檢測到所有樣本中的陽性對照,其中一個樣本含有三個靶標,一個樣本含有orf1ab和 N標靶,最後一個樣本含有orf1ab標靶(S1 表)。
收集的141 個陽性臨床樣本同時使用MM試劑盒、OT-2內部方法和MM內部方法進行核酸萃取,並透過qPCR檢測洗脫的SARS-CoV-2 RNA。記錄每個目標的陽性/陰性結果和擴增循環閾值 (Ct)。根據製造商的說明,當三個目標區域中至少一個擴增且 Ct<40 時,樣本被視為陽性。所有運行中包含的陰性對照在所有情況下均產生陰性 PCR 結果。
141 個樣本中,123 個樣本透過至少一種萃取方法檢測出 SARS-CoV-2 陽性,而 18 個樣本透過三種方法檢測均為陰性。這可能是由於樣本在採集期間降解所致,因為它們已在 4°C 下儲存了約 48 小時 [9]。依方法分類,114 個樣本使用MM試劑盒檢測呈陽性,111 個樣本使用內部OT-2 檢測呈陽性,118 個樣本使用內部MM 檢測呈陽性。成對比較發現它們檢測SARS-CoV-2 的性能沒有顯著差異(MM試劑盒Vs OT-2內部,P = 0.5465 ;MM試劑盒Vs MM內部,P = 0.3865;OT-2內部Vs MM內部,P = 0.0961)。 18 個樣本透過三種方法中的一些方法檢測呈陰性。這些具有較高的 Ct 值, orf1ab和 N 標靶的中位數分別為 38.68 和 38.19(在這些樣本中,S 標靶未透過任何方法擴增)。比較所有方法和標靶的配對線性迴歸和相關性分析顯示R 2值在0.85 和0.95 之間,Bland-Altman 分析顯示在整個Ct 範圍內一致性是一致的(S1 圖)。
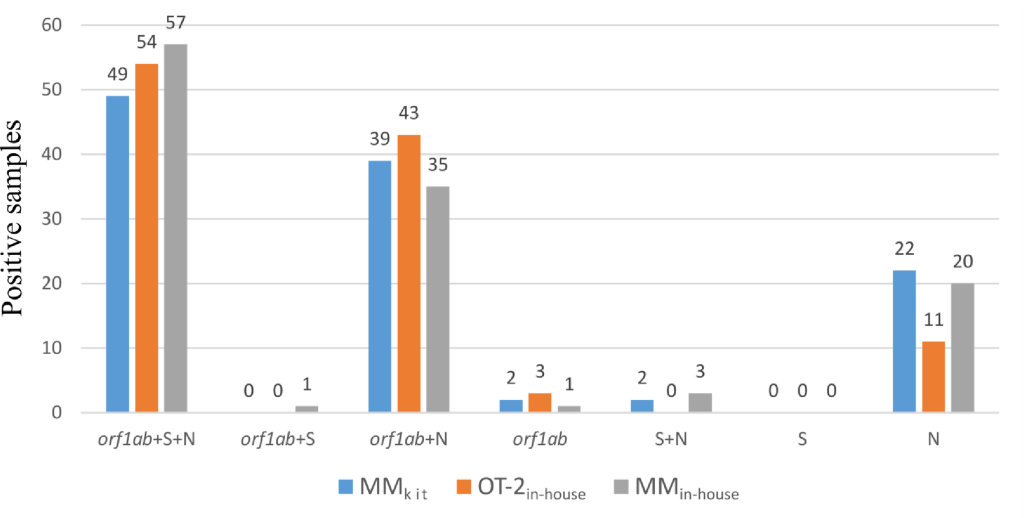
在使用MM試劑盒萃取的樣本中,43% 可偵測到三個標靶(orf1ab 、 N 和S ),在使用內部 OT-2 提取的樣本中,49%可檢測到,在使用內部MM 提取的樣本中,49% 可檢測到(圖1)。在 34%、39% 和 30% 的樣本中檢測到了orf1ab和 N 靶標,在 19%、10% 和 17% 的樣本中僅擴增了 N 靶標。只有極少數樣本因單獨擴增orf1ab標靶(6)、orf1ab + S(1)或N + S(5)標靶而被視為陽性,且沒有樣本以S 基因作為唯一的陽性標記。事實上,該檢測中的 S 標靶明顯缺乏靈敏度,且與診斷決策無關。使用OT-2內部協議檢測到兩個或三個目標的樣本佔87%(97 個樣本),使用MM內部協議檢測到兩個或三個目標的樣本佔82%(95 個樣本),使用MM試劑盒偵測到兩個或三個目標的樣本佔79% (90 個樣本)。
考慮配對樣本時,在orf1ab ( P = 0.437)、N ( P = 0.686) 和S ( P = 0.794) 標靶的Ct 值中,MM 試劑盒和OT-2 內部方案之間的Cts 沒有顯著差異( 圖2 )。與 MM 試劑盒 ( orf1ab ; P < 0.00001 , N ; P < 0.00001 , S ; P = 0.00148 )和OT - 2內部方案( orf1ab ; P < 0.00001, N; P = 0.00008, S; P = 0.00252)相比,MM內部方案在所有標靶中的Cts 確實顯著較低。
圖2.箱線圖顯示使用MM試劑盒、OT-2內部方法和MM內部方法獲得的orf1ab 、S 和N 目標的Ct 值分佈。 y 軸顯示擴增循環 (Ct)。顯示每個資料集上的資料點數量。
使用MM試劑盒、OT-2內部試劑盒和MM內部試劑盒對orf1ab標靶的中位擴增循環(CI:95%)分別為35.53 (33.82–36.36)、35.58 (34.33–36.21) 及34.8 (33.71–35.29)。對於S 基因,中位擴增循環(CI:95%) 為30.16 (28.56–33.08)、31.32 (29.22–32.88) 和31.07 (29.36–32.90);對於N 靶標,中位擴增循環(CI:95 %) 為34.83 (33.93–35.97)、34.64 (33.42–35.29) 和 34.28 (33.52–35.10)。
使用OT-2內部協議萃取96 個樣本的核酸,總成本為107 歐元(試劑37 歐元和實驗室器具70 歐元),實際操作時間為10 分鐘,萃取時間為3 個半小時(腳本每次運行處理48 個樣本,因此必須完成兩次)。 MM內部成本為66 歐元(試劑37 歐元和實驗室器具29 歐元),MM 試劑盒成本為472 歐元(試劑443 歐元和實驗室器具29 歐元) 。兩種協議的實際操作時間均為 40 分鐘,提取時間均為 30 分鐘。值得注意的是,雖然96 個樣本的OT-2 協議比MM內部協議貴40 歐元,但所需的初始投資明顯較低,OT-2 系統(包括模組和移液器)約10,000 歐元,MagMAX TM系統約為50,000 歐元。
本文介紹了兩種低成本病毒 RNA 萃取和臨床樣本 SARS-CoV-2 檢測方法,其性能與商用試劑盒相當。儘管內部方案萃取 DNA 對照的效率低於商用試劑盒,但在臨床樣本中,整體靈敏度並未受到影響,這可能是因為內部方案使用更大的樣本起始量來彌補較低的效率。
設定 OT-2 系統進行 RNA 萃取需要對沒有經驗的團隊進行密集編程,但提供了一種經濟高效的替代方案,能夠在一次運行中提取 48 個樣本。這項工作中使用的腳本已上傳到開放存取軟體儲存庫 GitHub,在那裡可以找到許多用於這些和類似應用程式的協定。這應該有助於其他工作人員避免或減少程式步驟。該協議幾乎不需要動手時間,並且使用容易獲得的試劑。此外,與其他提取系統相比,該設備所需的投資較低,使其適用於中低資源設施。 MagMAX TM Express-96 是一種快速、半自動設備,每次運行能夠提取 96 個樣本。 MM試劑盒提供用於滅活、裂解、洗滌和洗脫的試劑,可以以具有競爭力的成本用於不同的基質和樣品類型。另一方面,MM內部協議利用該系統的半開放方法,以其他化學品取代商業解決方案,使其更具成本效益。在這兩種情況下,都必須手動準備深孔板、緩衝液和樣品,這會增加總提取時間和操作錯誤風險。這兩種內部協議的主要缺點是,當處理黏稠樣本時,黏液、高黏性多醣、白血球、紅血球、血紅蛋白、蛋白酶和含有大量細胞核酸的細胞碎屑會阻礙RNA 萃取或抑制PCR 反應[ 10- 12 ] 。為了部分克服這個問題,可以在萃取前對樣品進行加熱和渦旋或離心,但這會增加動手時間和反應時間。當使用內部MM時,洗脫樣本在某些情況下可能含有微量的磁珠,但這不會影響 RT-PCR 反應的表現。
在這三個系統中,陰性對照在所有情況下均為陰性,顯示在這些系統中處理原始樣本時不存在交叉污染問題。不過,與非自動化系統一樣,應採取預防措施,將 PCR 前和 PCR 後操作分開。如果使用 OT-2 模組設定 PCR 後反應(例如定序),則不應使用它從樣本中提取核酸,除非徹底淨化。
這項研究的主要優勢在於,這些方法都是在臨床微生物實驗室中以真實樣本進行測試的。方法之間的比較並不繫統,這是一個重要的限制。事實上,設計的目的是優化每個系統的結果,因此輸入是不同的。系統地探索輸入樣本量以及其他試劑量將是有益和有益的,但這超出了這項研究的目的,即比較臨床實驗室環境中系統與真實樣本的性能。
總之,這裡介紹的兩種內部核酸萃取方法可有效實現 SARS-CoV-2 的高通量診斷,且成本僅為其他商業試劑盒的一小部分,且不損失靈敏度。
經驗豐富的服務團隊和強大的生產支援團隊為客戶提供無憂的訂單服務。